Милдронат: кто потребитель рецептурного лекарства?
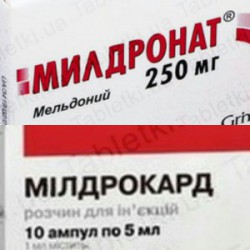
Поводом для написания статьи стали единогласные решения судов трех инстанций по делу № 910/16297/14. Торговая марка «Милдрокард», принадлежавшая белорусской компании, отменена по причине сходства до степени смешения с более ранним знаком истца из Латвии «Милдронат», который еще и признан общеизвестным.
Оговорюсь, что не имею к спору и его сторонам никакого отношения и всю информацию о нем почерпнул из текстов судебных решений: Хозяйственный суд г. Киева от 26 октября 2015 г.; Постановление Киевского апелляционного хозяйственного суда от 08 ноября 2016 г. и Постановление Высшего хозяйственного суда Украины от 07 февраля 2017 г.
По традиции, в деле было две судебные экспертизы с прямопротивоположными результатами, а суд поддержал выводы одной и отверг вторую. Меня заинтересовал ответ на вопрос о схожести двух наименований до степени смешения, хотя были и другие вопросы.
Упустим оценку противопоставленных знаков по критериям графики, фонетики и семантики – очевидно, что сходство есть (хотя общая часть названия не всегда доказывает схожесть, ведь на рынке сосуществуют «синуфорте» и «синупрет»). Как известно, обозначение считается схожим до степени смешения, если оно ассоциируется с другим обозначением в целом, несмотря на отдельные отличия элементов (п. 11.1.5 Методических рекомендаций по отдельным вопросам проведения экспертизы заявок на знак для товаров и услуг. ГП Укрпатент, 2014).
У кого должна возникать такая ассоциация? Если раньше практика полностью полагалась на субъективное мнение эксперта, то в п. 11.1.5 вышеупомянутых Методических рекомендаций появляется фигура потребителя: «Главным будет первое зрительное восприятие исследуемых обозначений. Именно первое зрительное восприятие любого объекта имеет влияние на сознание человека, аналогичным образом в сознании потребителя запоминается и обозначение».
В текстах судебных решений я не обнаружил ответа на один вопрос – учитывал ли суд особенности покупки потребителем лекарственных средств маркированных спорными знаками? Если не учитывал, то нужно ли это принимать во внимание при оценке схожести?
Не скрою, что на дальнейшие размышления меня вдохновил подход Court of Justice of the European Union (CJEU) к учету всех факторов, которые могу повлиять на сходство торговых марок (ТМ).
Схожесть до степени смешения означает риск, что, увидев чужой знак на товаре, потребитель может подумать, что товар произведен тем предприятием, со знаком которого он уже знаком, или экономически связанным предприятием.
В судебной практике CJEU сложился подход – схожесть до степени смешения устанавливается в соответствии с восприятием потребителем такого товара, принимая во внимание все факторы, существенно влияющие на обстоятельства дела. Для оценки нужно учитывать обычного, но достаточно хорошо информированного и внимательного потребителя этой категории товаров.
Практика CJEU требует разделять уровень внимания обычного потребителя в зависимости от того относится ли товар к группе товаров ежедневного потребления (средний уровень внимания) или к особенной группе товаров (повышенный уровень внимания).
Коль скоро наше дело касается ТМ на лекарственные средства, возникает вопрос: нужно при оценке схожести знаков для лекарств учитывать два обстоятельства:
(1) является ли препарат рецептурным;
(2) кого следует считать потребителем рецептурного препарата для целей оценки сходства знаков до степени смешения: врача, который выписал рецепт и/или пациента, который купил по рецепту лекарство?
Тексты судебных решений по делу № 910/16297/14 содержат противоречивые упоминания статуса препаратов – в одном абзаце «Милдронат» назван рецептурным (в номинации премии 2005 года), а буквально через один абзац – безрецептурным (при оценке осведомленности специалистов в отрасли кардиологии).
Сайт Государственного реестра лекарственных средств сообщает, что оба препарата – рецептурные. Во-первых, то означает запрет на рекламу любыми способами, кроме специализированных изданий для медицинских учреждений и врачей, а также на семинарах и конференциях по медицинской тематике (ст. 21 Закона Украины «О рекламе»).
Значит, производитель лишен возможности коммуницировать с конечным потребителем – пациентом – традиционными средствами: рекламой на телевидение, радио и т.д. Остаются только врачи и фармацевты.
Во-вторых, для рецептурных лекарств предусмотрен иной порядок покупки потребителем.
Право выписывать рецепт имеет только врач (кроме одного исключения), т.е. человек со специальным образованием и только на лекарственные средства, зарегистрированные в Украине (за небольшим исключением).
Поскольку в обоих лекарственных средствах международное непатентованное наименование «Meldonium», формально врач в рецепте должен указать именно его. Указывать торговое наименование («Милдронат» или «Милдрокард») врач может, если у средства нет МНН (п. 1.9. Правил выписывания рецептов на лекарственные средства и изделия медицинского назначения утверждены Приказом МОЗ Украины от 19.07.2005 №360).
В идеальном варианте пациент – своего рода посредник между врачом и работником аптеки, который приносит рецепт, где указана МНН, а не торговая марка препарата. Пациент может сказать название по памяти, но скорее всего, попытается разобрать легендарный врачебный почерк. Еще боле надежный вариант – отдать рецепт фармацевту, который согласно МНН предложит покупателю ассортимент средств, содержащих вещество.
Вся эта картина рушится о суровую действительность – врач прямо в рецепте указывает пациенту торговые названия лекарственных средств, которые нужно купить для лечения.
Отсюда ряд вопросов: (1) нужно ли учитывать вероятность перепутать лекарства у врача, который выписывает рецепт пациенту? (2) насколько высока вероятность, что пациент перепутает одно лекарство с другим, если его название указано в рецепте? (3) надо ли применять к лекарствам особый подход при оценке сходства знаков до степени смешения?
Судя по практике CJEU, за последние 15 лет сложился подход в отношении споров о схожести названий лекарственных средств (и вообще всей группы товаров 5 класса МКТУ). Источник информации — Likelihood Of Confusion In Trademark Law: A Practical Guide Based On The Case Law In Community Trade Mark Oppositions 2002 — 2012.
Кто потребитель фармпрепаратов и какой у него уровень внимания?
Начнем с того, что общее понятие, которым оперирует практика суда – «relevant public». Одно из знаковых дел в части определения «relevant public» — спор о схожести названий «PREZAL» и «PRAZOL» (T-95/07, Aventis Pharma v. OHIM–Nycomed (2008), где суд применил появившийся ранее подход о врачах и высоком уровне внимания потребителя, а также о влиянии рецепта на степень схожести (см. дело 2004 года Hoffman — La Roche A.G v Pfizer Products Inc – BL O/088/04).
Так вот для фармацевтических препаратов «relevant public» состоит не только из конечных потребителей. Очевидно, что при их выборе важную роль играют посредники (intermediaries who deal with the product commercially) в лице работников аптек (для нерецептурных средств) и врачи, выписывающие рецепт.
Список case-law, в котором отражен широкий подход к понятию потребителя лекарств: Madaus v. OHIM–Optima Healthcare Case T-202/04 (2006); Alcon v. OHIM Case C-412/05 (2007); Aventis Pharma v. OHIM–Nycomed Case T-95/07 (2008); GlaxoSmithkline v. OHIM– Serono Genetics Inst., Cases T-493/07, T-26/08, T-27/08 (2009); Ineos Healthcare v. OHIM–Teva Pharm. Indus. Case T-222/09 (2011).
Появление среди потребителей врача и фармацевта означают, что оценка уровня внимания для них от средней повышается до высокой (и даже до экспертной). У лиц, которые получили специальное образование и являются профессионалам, очень низка вероятность ошибки при указании названия лекарства, тем более рецептурного.
Конечный потребитель тоже относится к покупке лекарств более внимательно. Однако высокий уровень внимания потребителя обусловлен не тем, что его консультируют специалисты в сфере медицины, а потому что лекарства влияют на состояние здоровья конечного потребителя: чем серьезнее заболевание – тем выше уровень внимания при выборе лекарства
Список case-law, в котором отражен подход к оценке внимания потребителя: Novartis v. OHIM–Sanochemia Pharmazeutika Case T-331/09 (2010); T-131/09, Farmeco v. OHIM–Allergan (2010); Kureha v. OHIM–Sanofi-Aventis Case T-487/08 (2010); Mundipharma v. OHIM–Altana Pharma Case T-256/04 (2007).
Более того, практика пришла к выводу, что самого факта, что посредники-профессионалы в сфере медицины могут влиять на решение потребителя о выборе лекарства недостаточно, чтобы исключить возможность введения в заблуждение потребителя относительно происхождения товара.
Список case-law, в котором отражен подход к влиянию врачей на покупку: Longevity Health Prods. v. OHIM–Tecnifar Case T-161/10 (2011); Longevity Health Prods. v. OHIM–Gruppo Lepetit Case T-363/09 (2010); Procaps v. OHIM–Biofarma Case T-35/09 (2010); Armour Pharms. v. OHIM–Teva Pharm. Indus. Case T-483/04 (2006).
При оценке сходства и вероятности ведения в заблуждение конечного потребителя, следует учитывать, продается ли лекарство свободно или только по рецепту врача (Armour Pharms. v. OHIM–Teva Pharm. Indus. Case T-483/04 (2006). Также нужно учитывать каналы дистрибуции и способы продвижения – рекламу и маркетинговые активности сравниваемых обозначений и товаров.
По традиции, прошу считать данную заметку приглашением к дискуссии об улучшении практики разрешения споров на торговые марки в фармбизнесе.
Если пост понравился – поделитесь им и подписывайтесь на наш блог.
Навігація
Попередня публікація: ← А у нас картошка фри запатентованная!
Наступна публікація: Обчислення строків: огляд судової практики →